设计理念
通过生活中的化学创设学习情境和开发实践环节,帮助学生用所学的知识解决生活中的问题,确立学生在学习中的主体地位。在学习过程中体验、思考、感悟,提高学习兴趣和实验能力、实现学生的可持续发展。
一、教学目标:
1.1知识与技能
(1) 熟练进行基本的化学实验操作,掌握物质鉴别的一般方法和原则
(2) 熟练掌握 单一物质的鉴别及实验报告的填写方法
(3) 能够灵活用常见的物质进行混合溶液及的鉴别
1.2过程与方法
(1) 熟练将物质分类并知道它们之间的相互反应关系
(2)熟悉常见物质的物理、化学性质及酸碱性,提高实验能力及知识点的灵活运用
1.3情感态度与价值观
通过联系生活引入实验探究的过程,加深对各类常见物质的认识,并能够解决问题,激发学习化学的兴趣和热情,建立严谨科学的学习态度及价值观
二.教学重点与难点:
重点:掌握常见物质的鉴别及实验设计
难点:学会化学反应后生成的溶液以及混合溶液中溶质成分的检验方法
三. 教学流程
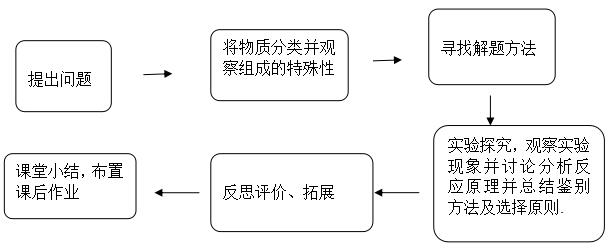
四、教学过程: 师生交流讨论,实验探究
- 化学就在我们身边(请用任意试剂、多种方法鉴别)
⑴ 鉴别黄金?铜锌合金?
★总结思路:1.物质的鉴别:根据被鉴别的几种物质的___________差异及实验时的不同__________,将其一一区别开来。
性质:物理性质和化学性质. 现象:发光 、 放热 、变色 、放出气体、 生成沉淀 。⑵.厨房中重要的调味品食盐和蒸馒头用的纯碱两种白色粉末如何鉴别?
★归 纳 与反思: 鉴别的关键:熟知物质的__________尤其是有特殊现象的__________
鉴别的原则: 方法_________ 、现象_________
鉴别的步骤:取样、加试剂、描述现象、得出结论。
2.只用一种试剂加以鉴别
⑴氯化钠、氢氧化钠、稀盐酸:
⑵CaCO3、NaOH、CuSO4三种白色固体
⑶鉴别BaCl2、Na2SO4、Na2CO3三种无色溶液
★思考总结——物质鉴别的方法和方法选择的一般原则
⑴物质之间有__________差异时,可选用指示剂或pH试纸鉴别。
⑵物质之间有明显的溶解度和溶液颜色差异,则用__________来鉴别;
⑶抓住溶液中的特征酸根如 _________________________ 等,综合分析选试剂,使之产生不同的现象加以鉴别。
3.不用外加试剂,仅用组内物质之间两两反应鉴别
NaCl、Ba(NO3)2、NaOH、CuSO4四瓶溶液
4.混合溶液中溶质成分的鉴别
⑴工业上用电解饱和食盐水制烧碱,化学反应方程式为2NaCl+2H2O→2NaOH+H2+Cl2↑
请检验制得的烧碱中是否含有少量的氯化钠?
步骤①的目的是_____________________________________________________.
★解决方法:根据化学反应后元素的种类不变,反应后溶质的成分只可能有两种情况:
⑴只有_________ ⑵含有生成物和其中一种________(即有一种反应物过量)
★对反应物的检验有两种情况:
①生成物不会对反应物的检验造成干扰,只需检验__________即可 .
②若生成物会对反应物的检验造成干扰,先______________,再检验反应物 .
⑵废液缸中剩有大量的实验室制取二氧化碳的混合溶液(不考虑其他杂质),某同学取上层清液于烧杯中,逐滴滴入Na2CO3溶液至过量。记录滴入Na2CO3溶液质量(X)与有关量的变化关系如右图所示。由图示可以得到的信息是:
①上层清液中的溶质是:__________________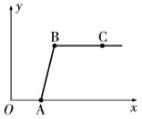
②上述实验的现象__________________________________,
③OA段、AB段发生反应的化学方程式是________________________
__________________________图中纵坐标(y)表示生成___________的质量,
④.B点的溶质是_______, C点溶液中的溶质是:________________,如何检验?
⑶同学们用氧化铜,盐酸和氢氧化钠新制一定量的氢氧化铜,
实验步骤如下:
甲同学将氧化铜中放入稀盐酸,发现“微热后,液体呈黑色浑浊,”你认为原因是__________________________,黑色物质是_________,溶液中的溶质是________.
乙同学将氧化铜中放入稀盐酸,发现“微热后,液体呈蓝色,”再向其中逐滴滴入
氢氧化钠溶液,一段时间后产生了蓝色沉淀,请分析蓝色溶液中溶质的成分_________
(五)回顾总结
6.课后练习:联系提升;方法深化;
请设计实验鉴别海水中提取的粗盐中含有Na2SO4 MgCl2 CaCl2 三种可溶性杂质





