执教者:崔 鹏
班 级:上海市第二初级中学九(5)班
时 间:2018年5月16日星期三
地 点:诚勇楼二楼化学实验室
【教学目标】
1.复习典型的酸与碱的化学性质和中和反应的规律。
2.学会分析中和反应过程中、反应后溶液中溶质的成分及其量的变化。
3.根据酸、碱、盐的知识设计实验方案、验证猜想与假设,体会发现和利用物质之间性质差异的重要性。
4.理解和会用图像的形式表达中和反应过程中溶液酸碱性的变化和溶质量的变化。
5.感悟化学变化的实质,体会实事求是、严谨细致的科学态度。
【教学重点】
根据所提出的问题做出猜想,并指出猜想的依据;设计化学实验方案进行探究。
【教学难点】
感受把物质的化学性质、反应规律、实验现象、图像表达联系起来,揭示内在关系与规律的过程。
【教学过程】
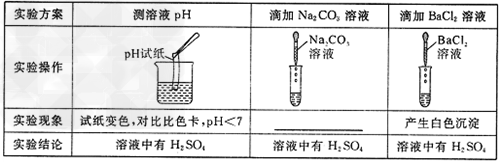
1.实验探究活动:取一定量的稀盐酸和氢氧化钠溶液在试管中进行实验,对反应后所得溶液的酸碱性与溶质成分进行探究。
[探究目的]探究稀盐酸与氢氧化钠反应后,所得溶液的酸碱性及溶液中的溶质是什么?
[提出猜想]所得溶液的酸碱性和溶质可能是:
猜想1:所得溶液可能呈 性,溶质是 ;
猜想2:所得溶液可能呈 性,溶质是 ;
猜想3:所得溶液可能呈 性,溶质是 。
[实验探究]
[分析思考] ⑴本实验中,反应后的溶液若呈碱性,则溶液中使其呈碱性的物质是 ;若呈酸性,则溶液中使其呈酸性的物质是 。
这些物质来源于 。
(2)探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑虑 。
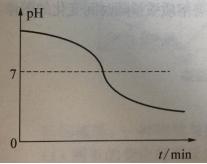
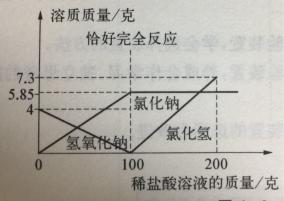
情境变化、问题思考一:在氢氧化钠溶液中不断滴入稀盐酸,在此过程中,溶液的酸碱性和溶质成分如何变化?用图像的方法表示。

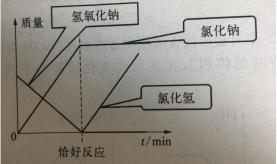
定量分析、问题思考二:用7.3%的稀盐酸不断滴入40克10%的氢氧化钠溶液中,溶液中溶质的变化与所加稀盐酸的量的关系如何变化?用图像的方法表示。
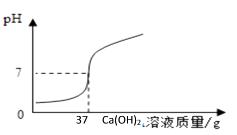
2.巩固练习与思考:为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小明和同学们通过测定反应后溶液的pH,得到了如图所示的pH曲线。
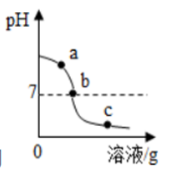
(1)由图可知该实验操作是将 滴加到另一种溶液中。
(2)该反应的化学方程式为 ;
(3)实验过程中,小明取了a、b、c三处反应后的溶液于三个烧杯中,却忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液.
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3═CaCO3↓+2NaCl.
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现 的现象.结论:该样品是a处溶液.
②为进一步确定b或c处溶液,又设计了以下方案:

3.方法与思路总结、课堂小结
(1)酸、碱中和反应后所得溶液中溶质的成分分析思路:
A (酸)+ B(碱) = C (盐)+ H2O
一般情况下,溶质的成分有以下几种可能:1.C 2.C、A 3.C、B
做此类题时,努力做到:
1.读题中找到目的(实验目的);
2.读题后大胆假设(合理猜想);
3.做题中顺藤摸瓜(分析推理)……
(2)用图像呈现化学实验过程简洁而具有系统性,能反应一个量的变化引起另一个量变化的情况。
需要明确图像中横、纵坐标所对应的物理量及其单位,注意图像变化形势,明确其中的变化规律。
【课后作业】
| 1. 化学课堂上,围绕“酸碱中和反应”,同学们分成若干小组,在老师引导下
开展探究活动。请你参与学习并帮助填写空格。 【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中。 【学生板演】⑴该反应的化学方程式 __________________________ 。 【提出问题】实验中未观察到明显现象,同学们产生了疑问: 反应后溶液中溶质是什么呢? 【假设猜想】⑵针对疑问,太家纷纷提出猜想。甲组同学的猜想如下: 猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4 猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH 不合理的理由是 _ __。 【实验探究】⑶①丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液, 无明显变化,溶液中一定没有 ________ 。 ②为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、 铜片、BaC12溶液、Na2CO3溶液,进行如下三个方案的探究。
|
| 【得出结论】通过探究,全班同学一致确定猜想_______是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。 同时指出【实验探究】⑶②中存在两处明显错误,同学们经过反思发现了这两处错误: 实验操作中的错误是______________________ 。实验方案中也有一个是错误的,错 误的原因是 ______________ ______________。 |
2、在探究氢氧化钙与稀盐酸中和反应实验时,忘记了滴加酚酞溶液,无法判断反应进行到何种程度,同学们决定对反应后溶液中溶质的成分进行探究.写出该化学反应的方程式
【提出问题】反应后溶液中的溶质是什么?
【做出猜想】猜想一:CaCl2和Ca(OH)2 猜想二:CaCl2和HCl 猜想三:
请将猜想三补充完整,并写出你猜想的理由是 。
【设计方案】

【得出结论】反应后溶液中的溶质是
3.某化学小组在探究碱的化学性质时,做了如图所示的两个实验.
(1)写出A试管中发生反应的化学方程式 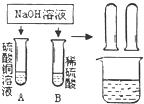
(2)实验结束后,同学们将A、B两试管中的废液倒入同一洁净的烧杯,烧杯中出现蓝色沉淀.
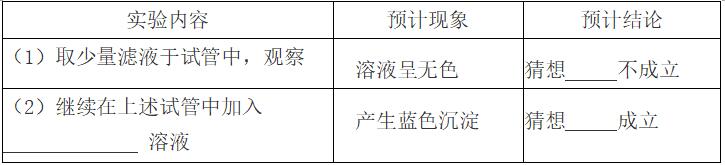
小组同学将烧杯中的物质进行了过滤,对滤液中成分有如下猜想:
【提出猜想】
甲:滤液中的溶质是Na2SO4、CuSO4 乙:滤液中的溶质是Na2SO4、H2SO4
丙:滤液中的溶质是 丁:滤液中的溶质是Na2SO4
【交流讨论】同学们对以上的猜想提出质疑,认为猜想 不合理,理由是
【设计实验】同学们通过以下的实验对猜想进行验证,请你完成实验报告.
4.小强在用稀盐酸和氢氧化钠溶液进行中和反应实验时,根据实验数据绘制了下图,请回答:

(1)该实验操作是将________滴加到另一种溶液中。
(2)当加入溶液的质量为ag时,向所得溶液中滴加酚酞溶液,溶液呈______色。
(3)当加入溶液的质量为bg时,所得溶液中的溶质是________。
(4)写出该反应的化学方程式: 。
5.某小组同学想对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为20%的氢氧化钙溶液进行中和,如下图所示.请你计算废水中盐酸的溶质质量分数(写出具体的计算过程)
6.如图,甲、乙两位同学一起在实验室进行氢氧化钠与盐酸中和反应的实验.
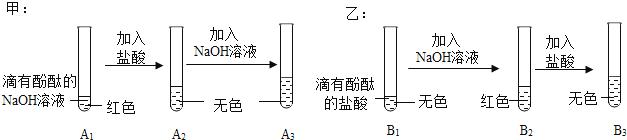
(说明:图中A1、A2、A3、B1、B2、B3均为溶液编号)
根据图中实验,请你与甲、乙同学一起完成下列探究: